FDA warnt vor potenziellem Meningitis-Risiko im Zusammenhang mit Lamictal
Eine neue Nebenwirkung im Zusammenhang mit dem Psychopharmakon Lamictal wurde entdeckt.
Am 12. August gab die US-amerikanische Food and Drug Administration (FDA) eine neue Warnung heraus, dass Lamictal (Lamotrigin) ein sehr geringes Risiko hat, eine als aseptische Meningitis bekannte Erkrankung zu verursachen.
"Aseptische Meningitis ist eine seltene, aber schwerwiegende Nebenwirkung der Anwendung von Lamictal", sagte Russell Katz, M.D., Direktor der Abteilung für Neurologieprodukte im FDA-Zentrum für Arzneimittelbewertung und -forschung. "Patienten, bei denen Symptome auftreten, sollten sofort ihren Arzt konsultieren."
Lamictal ist zur Behandlung von Anfällen und bipolaren Störungen zugelassen. Während viele Antikonvulsiva zur Behandlung von bipolaren Störungen verwendet werden, ist Lamictal eines von nur mehreren, die von der FDA für die Erhaltungstherapie zugelassen sind. Insbesondere ist Lamictal zur Behandlung der depressiven Phase der Störung nützlich und eines der wenigen Medikamente, die nicht mit Gewichtszunahme verbunden sind.
Vor der Zulassung durch die FDA wurden keine Fälle von Meningitis festgestellt. Die FDA wurde jedoch durch routinemäßige Überwachung unerwünschter Ereignisse und Kommunikation mit dem Hersteller des Arzneimittels auf den Zusammenhang zwischen Lamictal und aseptischer Meningitis aufmerksam.
Seit der Zulassung des Arzneimittels im Dezember 1994 bis November 2009 wurden bei Patienten, die Lamictal einnahmen, 40 Fälle von aseptischer Meningitis festgestellt.
Es wurde berichtet, dass die Symptome kurz nach Beginn der Behandlung mit Lamictal innerhalb von ein bis 42 Tagen nach Beginn der Medikation auftraten.
35 der 40 Patienten mussten ins Krankenhaus eingeliefert werden. In den meisten Fällen endeten die Symptome nach Absetzen von Lamictal. In 15 Fällen traten häufig schwerwiegendere Symptome auf, wenn die Patienten das Medikament neu starteten.
Alle Medikamente haben mögliche Nebenwirkungen. Bevor ein Medikament von der FDA zugelassen wird, werden klinische Studien abgeschlossen, um sicherzustellen, dass es sicher ist und dass die Vorteile der Behandlung das Risiko von Nebenwirkungen überwiegen. Diese Studien umfassen jedoch nicht die gleiche große Anzahl von Patienten, die das Arzneimittel letztendlich verwenden werden. Daher werden die Medikamente nach der Zulassung weiterhin überwacht.
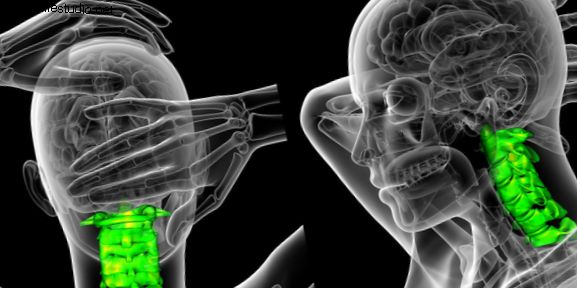
Aseptische Meningitis hat eine Reihe von Ursachen, einschließlich, aber nicht beschränkt auf Viren, toxische Substanzen, einige Impfstoffe, Autoimmunerkrankungen und bestimmte Medikamente, einschließlich Lamictal. Symptome können Kopfschmerzen, Fieber, Schüttelfrost, Übelkeit, Erbrechen, steifer Nacken und Lichtempfindlichkeit sein. Möglicherweise ist ein Krankenhausaufenthalt erforderlich.
Aseptische Meningitis ist eine Entzündung der Schutzmembranen (Meningen), die das Gehirn und das Rückenmark bedecken. Aseptische Meningitis unterscheidet sich von bakterieller Meningitis darin, dass keine bakterielle Infektion vorliegt. Am häufigsten werden Patienten mit aseptischer Meningitis, die durch ein Medikament verursacht werden, mit Schmerzmitteln behandelt und erholen sich innerhalb von ein oder zwei Wochen vollständig.
Bei Verdacht auf Meningitis sollte die zugrunde liegende Ursache schnell diagnostiziert werden, damit die Behandlung sofort eingeleitet werden kann. Ein Arzt sollte die Behandlung mit Lamictal abbrechen, wenn keine andere eindeutige Ursache für eine Meningitis festgestellt wird.
Die Agentur arbeitet mit dem Arzneimittelhersteller GlaxoSmithKline zusammen, um die Verschreibungsinformationen und den Leitfaden für Patientenmedikamente zu aktualisieren und dieses Risiko zu berücksichtigen.
Es ist wichtig, die Einnahme von Medikamenten nicht abzubrechen, ohne dies zuvor mit Ihrem Arzt besprochen zu haben. Wenn bei Ihnen Symptome wie Kopfschmerzen, Fieber, Schüttelfrost, Übelkeit, Erbrechen, steifer Nacken und Lichtempfindlichkeit auftreten, insbesondere wenn Sie kürzlich mit der Einnahme von Lamictal begonnen haben, informieren Sie Ihren Arzt.
Quelle: FDA